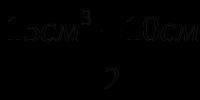Общая формула галогенов. Физические и химические свойства галогенов
Фтор - окислитель ракетных топлив; ClF 3 - окислитель жидких реактивных топлив и как фторирующий агент. НF - для получения синтетического криолита К 3 [АlF 6 ], для травления стекла. Фтор и фторхлоруглеводороды используют для получения фреонов, хладоносителей в холодильных установках и кондиционерах. Основное потребление фтора осуществляется в ядерной промышленности, в электротехнике, при изготовлении полимерных материалов, среди которых фторопласт – 4, (тефлон). Полимеры фтора обладают ценными качествами: негорючестью, химической стойкостью, отсутствием хрупкости при низких температурах и др. Фторсодержащие каучуки сохраняют эластичность и не разрушаются в кислотах.
Хлор - для получения хлороводорода (НСl) и хлористоводородной (соляной) кислоты; для отбеливания тканей и бумажной массы, для обеззараживания питьевой воды (~1,5г на 1 м 3 Н 2 O), в производстве хлорной извести, и отравляющих веществ. Хлор применяют также для получения хлорпроизводных органических соединений растворителей - СНС1 3 ; CCl 4 .
НС1 -используют для получения хлороводородной (соляной) кислоты и её солей - хлоридов различных металлов. Соляную кислоту применяют в медицине, как лекарственный препарат. NaС1 - приправа к пище, для получения Сl 2 ; NaOH; Na 2 CO 3 ,мыла, а также является лекарственным препаратом.
А1С1 3 - катализатор в органических синтезах.
КI и NaI используют также в химическом анализе и изготовлении фотоматериалов.
АgВr - главный компонент светочувствительного слоя фотоплёнок и бумаги.
I 2 - в фармации для приготовления спиртовых растворов иода.
АgI - при изготовлении фотоматериалов.
Из оксосолей нашли применение хлораты: KClO 3 и NaClO 3 в производстве спичек и взрывчатых веществ, в пиротехнике. Мg(ClO 3) 2 - гербицид используется в борьбе с сорняками. Перхлораты нашли применение в пиротехнике.
Гипохлориты: KClO и NaClO - сильные окислители, применяют для отбеливания хлопчатобумажных и льняных тканей и бумажной массы. Отбеливающее действие связано с атомарным кислородом:
KClO + H 2 O + CO 2 ® KHCO 3 + HClO
Хлорная известь – CaOCl 2 - для дезинфекции и как дегазатор. Её применяют в сухом виде и в виде 0,2- 5%-ных растворов.
CaOCl 2 + 2H 2 O ® Ca(OH) 2 + 2HClO + CaCl 2
CaOCl 2 + CO 2 ®CaCO 3 + Cl 2
Бром и йод находят применение в органическом синтезе, для получения броморганических соединений, которыми пропитывают древесину, предохраняя её от гниения.
Галогены обладают токсическим действием, они оказывают раздражающее действие на слизистые оболочки, и органы дыхания. Избыток фторид-ионов в питьевой воде вреден для зубов и развития костей, а также вреден и его недостаток. Отмечено опасное влияние фреонов на сердечно-сосудистую систему. Токсичным действием обладают оксиды галогенов и интергалогениды (межгалогенные соединения).
Хлораты щелочных металлов: KClO 3 ; NaClO 3 и др. относят к кровяным ядам (вызывают распад эритроцитов). Необходимо учитывать также способность многих соединений галогенов к воспламенению и взрывному разложению (НClO 4), поэтому хранение этих веществ и работа с ними требует необходимых мер предосторожности и соблюдения правил техники безопасности.
Интергалогениды (соединения галогенов друг с другом)
Галогены могут образовывать между собой различные соединения. Обычно это одно-, двух-, трёх, пяти- и более (IF 7) - валентные соединения по отношению к фтору, хлору и брому общей формулой Г(Г) n . Значение n-нечётное и не превышает семи. Их получают непосредственно из элементов, или действием избыточного галогена на соответствующий интергалогенид:
Cl 2 + F 2 2ClF;
Br 2 + F 2 ® 2BrF
5F 2 + I 2 ® 2IF 5
F 2 + ClF 3 ® ClF 5
4F 2 + 2BrF ® 2BrF 5
3Cl 2 + I 2 ® 2ICl 3
Br 2 + Cl 2 ® 2BrCl
Это легколетучие соединения; большинство из них - малоустойчивые и очень реакционноспособные, но ни одно из них не взрывчато.
В присутствии галогенидов растворимость некоторых галогенов в воде повышается в связи с комплексообразованием:
I 2 + KI ® K - дииодоиодат калия
I - + I 2 ® -
Биологическая роль галогенов
Фтор
Фтор, также как и иод, в организме человека находится преимущественно в связанном состоянии (хлор и бром - в виде гидратированных ионов) и по своему содержанию (~7 мг, 10 -5 %)относится к микроэлементам.
Фтор необходим для нормального развития человеческого организма, при его недостатке развивается анемия. Но основная биологическая роль этого элемента связана с его участием в процессах развития зубов, костей и ногтей не только у человека, но и у животных. Он встречается во всех органах человека, но наиболее богатые из них - кости и зубы. В эмали зубов (0,01%) и костных тканях (его содержание в 100000 раз больше, чем в мягких тканях) фтор находится в минеральной форме, в виде труднорастворимой и кислотоустойчивой соли кальция - фторапатите – Ca 5 (PO 4) 3 F или 3Ca 3 (PO 4) 2 ´CaF 2 .
Биологическое действие фтора тесно связано с его содержанием и поступлением в организм с питьевой водой и пищей. Исследования баланса фтора в человеческом организме показали, что потребление фтора с водой составляет в среднем 1 мг/л. 90% фтора, поступающего в организм с питьевой водой, выделяется мочой. Исключая питьевую воду, с пищевым рационом человек получает ~0,2-0,3 мг фтора в день. Из пищевых продуктов организм человека усваивает фтор на 20% меньше, чем из воды. Поэтому необходим постоянный контроль питьевой воды на содержание в ней фтора.
При содержании фтора в питьевой воде менее чем 1 мг/л у людей развивается кариес зубов. При содержании фтора выше предельно допустимой концентрации - более чем 1,2 мг/л (известны местности, содержащие залежи фторапатитов, в которых фтора содержится более 8 мг/л) нарушаются процессы обновления костной ткани и развивается опасное заболевание – фтороз или флуороз, связанное с повышенной хрупкостью костей, их деформацией и общим истощением всего организма, как результат нарушения фосфорно-кальциевого обмена. Зубная эмаль при этом становится хрупкой и легко разрушается (содержание в них фтора превышает норму в 3-5 раз). Появляются и другие симптомы этой болезни - поражение щитовидной железы, почек и др. органов.
Коровье молоко содержит фтора от 0,1-0,2 мг в 1 л. В рыбах, моллюсках и съедобных водорослях в среднем содержится 0,5-1,5 мг фтора на 100 г свежей массы. Наибольшее содержание фтора из растительных объектов отмечено в чае.
В местностях, обычно горных или сильно удаленных от моря, содержание фтора, в питьевых водах и пищевых продуктах обычно намного меньше необходимой концентрации (менее 0,5 мг/л). Этот недостаток фтора приводит к кариесу зубов.
Согласно исследованиям, в эмали здоровых зубов содержится 0,01% фтора, в кариозных - 0,0069% и меньше. Как известно, минеральную основу зубных тканей (дентина) составляют следующие соли: Ca 5 (PO 4) 3 (OH) - гидроксилапатит, Ca 5 (PO 4) 3 Cl – хлорапатит (содержатся в дентине), и Ca 5 (PO 4) 3 F – фторапатит (содержится в эмали).
Фторапатит отличается большей твердостью и защищает эмалевый слой зубов от разрушения. При повреждении эмали под действием кислот, вырабатываемых бактериями, начинается кариес зубов - постепенное разрушение вследствие растворения минеральной основы его внутреннего участка:
Ca 5 (PO 4) 3 OH + 7H + ® 5Ca 2+ + 3H 2 PO 4 - + H 2 O
Имеются данные, согласно которым фторид-ионы сравнительно легко могут замещать гидроксид-ионы (ОН -) в гидроксилапатите, образуя более твердые и менее растворимые кристаллы – фторапатита:
Ca 5 (PO 4) 3 OH + F - Û Ca 5 (PO 4) 3 F + OH -
Поэтому в тех местностях, которые характеризуются недостаточным содержанием фтора в питьевой воде и повышенным заболеванием зубным кариесом, с профилактической целью осуществляют фторирование воды, путем добавления к ней определенных количеств NaF до нормы (1 мг/л).
Если эмаль повреждена незначительно, то возможна реминерализация зубной эмали путем употребления фторида натрия в качестве местного наружного средства (зубных паст):
NaF + Ca 5 (PO 4) 3 OH Û NaOH + Ca 5 (PO 4) 3 F
паста эмаль зубов
Одновременно с реминерализацией происходит подщелачивание среды ротовой полости и нейтрализация кислот вырабатываемых бактериями.
В плане экологического загрязнения окружающей среды можно отметить, что по сравнению с другими галогенами, прочно связанный фтор (в образуемых им соединениях), практически не участвует в химическом кругообороте и в малой мере выносится с атмосферными осадками. Однако значительную экологическую опасность представляют фторид-ионы, содержащиеся в необесфторенных фосфорных удобрениях и консервантах древесины - NaF и др. соединениях. Особенно токсичны галогенсодержащие органические вещества, которые применятются в качестве пестицидов.
Таким образом, фтор как микроэлемент в виде фторапатитов входит в состав зубной эмали и костной ткани. Он необходим для нормального развития человеческого организма. Его биологическое действие связано, прежде всего, с образованием нерастворимого фторапатита, защищающего эмалевый слой зубов. В зависимости от необходимой физиологической концентрации фтора в организме (что связано с поступлением его с питьевой водой и пищевыми продуктами) возможно развитие таких заболеваний как кариес зубов (содержание фтора в питьевой воде меньше 1мг/л) или фтороз - при более высоких концентрациях фтора.
Хлор
Хлор - необходимый и незаменимый для жизни макроэлемент. Его содержание в организме человека превышает 100 г (~0,15%), остальные галогены относятся к микроэлементам (10 -5 %).
В организме он находится в степени окисления -1 в гидратированной форме, как и бромид-ион (фтор и йод преимущественно в связанном состоянии). Хлор, в виде растворимых солей натрия, кальция, калия и др. содержится в различных биологических жидкостях и выполняет важную биологическую роль - обеспечивает ионные потоки через клеточные мембраны, участвует в поддержании постоянства осмотического давления крови и других жидкостей (осмотический гомеостаз), участвует в обеспечении необходимой концентрации катионов (химический гомеостаз); активирует некоторые ферменты (пепсин) в процессе выработки желудочного сока и регулировании водного обмена.
Хлороводородная кислота является составной частью желудочного сока человека и животных с W(HCl) от 0,3 до 0,5%. Хлорид натрия необходим для выработки соляной кислоты в желудочном соке. Выделение HCl из клеток слизистой оболочки желудка описывается следующим уравнением:
Cl - + H 2 CO 3 (кровь) HCO 3 - (кровь) + HCl (желудок)
Переход фермента пепсина в активную форму возможен в среде хлороводородной кислоты. В результате гидролитического расщепления пептидных связей пепсин обеспечивает переваривание белков:
R-CO-NH-R 1 + H 2 O RCOOH + R 1 NH 2
Таким образом, соляная кислота играет важную роль в процессе пищеварения. Чистую разведенную кислоту с W (HCl) = 8,2-8,4% применяют внутрь в каплях и микстурах (часто вместе с пепсином) при пониженной кислотности желудочного сока.
Вместе с другими ионами (K + , Na + , Ca 2+ и др.) ионы хлора участвуют в передаче нервных импульсов через мембраны нервных клеток, поддерживая возбудимость мышечных клеток. Хлорид-ионы - главные отрицательно заряженные ионы внутриклеточного раствора и межклеточных жидкостей, они образуют тонкие ионные слои по обеим сторонам клеточных мембран и участвуют, таким образом, в создании электрического мембранного потенциала, который регулирует процессы переноса неорганических и органических веществ сквозь мембраны. Этим объясняется его участие (вместе с ионами K + и Na +) в создании определенного осмотического давления и регуляции водносолевого обмена. Гидратированные хлорид ионы участвуют в поддержании физиологически требуемой наполненности клетки водой.
Почти все ткани живых организмов обладают свойствами полупроницаемости, в том числе и клеточная мембрана, через которую могут проходить лишь частицы определенного размера.
В отличие от бромид-ионов, хлорид-ионы обладают оптимальным радиусом для проникновения через мембраны клетки. Этим объясняется участие хлорид-ионов (вместе с ионами K + и Na +) в создании определенного осмотического давления крови и других биологических жидкостей (тканевых, лимфе и др.). Благодаря осмосу регулируется поступление воды в клетки и межклеточные структуры. В процессах усвоения пищи, обмена веществ, осмотические явления также играют большую роль. Растворы лекарственных препаратов, которые вводятся внутривенно или подкожно, должны быть изотоничны (содержать одинаковое количество осмотически активных частиц). Хлорид-ионы не токсичны в отличие от молекулярного хлора. Газообразный хлор раздражающе действует на слизистую оболочку органов дыхания, разрушает легкие. Вдыхание воздуха, содержащего хлор 0,05% в течение 1-2 ч, может привести к удушью и смерти. Хлор - первое боевое отравляющее вещество, примененное в 1915 г. германией в боях под Ипр (Бельгия). Предельно допустимая концентрация газообразного хлора в воздухе 0,001 мг/л.
Осмотическое давление крови человека при 310 К (37°С) составляет 780 кПа (7,7 атм). Такое же давление создает 0,9%-ный водный раствор NaCl (0,15 моль/л) который изотоничен с кровью и называется физиологическим раствором.
Однако, в крови кроме Cl - -ионов и ионов Na + имеются другие необходимые человеку вещества. В медицине используют обычно те растворы, которые содержат те же компоненты и в том же количестве, что и в крови. Иначе, в результате осмоса клетки будут или разбухать, пока не порвутся их стенки, или же сжиматься из-за потери воды. Разбухание (гемолиз) происходит в гипотонических растворах, т.е. в растворах с меньшей концентрацией, чем у изотонических растворов. Съеживание (плазмолиз) происходит в гипертонических растворах, концентрация которых больше концентрации изотонических. В лечебных целях, в качестве наружного средства используют гипертонические (W(NaCl) = 10%) растворы. Марлевые повязки, смоченные гипертоническим раствором NaCl, очищают раны по закону осмоса благодаря направлению тока жидкости наружу.
Суточная потребность хлорида натрия - 5-10 г. При заболеваниях желудка (гиперацидном гастрите) или язвенной болезни потребление NaCl должно быть сокращено из-за повышенной кислотности.
Избыточное потребление NaCl способствует появлению гипертонии.
Хлорид-ионы не обладают токсическим действием, но простое вещество – Cl 2 , как уже отмечалось, и его органические и кислородные соединения - высоко токсичны. Содержание хлора в воде (2´10 -6 г/мл) обуславливает антимикробные свойства воды и вызывает гибель самых разнообразных бактерий. При растворении хлора в воде образуется хлорноватистая кислота, которая легко проникает в микробную клетку и инактивирует ферменты:
Cl 2 + H 2 O « HCl + HClO
HClO « HCl + O
Интенсивность круговорота хлора в природе много больше других галогенов.
Подвижный, не образующий (в большинстве случаев) нерастворимых солей, хлор быстро выносится с атмосферными осадками, которые в виде пыли и аэрозолей поступают в почвы.
Экологически вредной формой хлора является хлороводород, выделяющийся многими производствами. В виде осадков он закисляет почвы. Но наибольшую экологическую опасность представляют хлорсодержащие пестициды, поэтому при их применении необходимо соблюдать нормы и технологию распределения.
Бром
Наибольшей биологической активностью обладает неорганическая форма брома - бромид-ионы (Br -). В организме они, также как и хлорид-ионы, находятся в гидратированной форме за счет ориентации и координации полярных молекул воды:
Гидратация - взаимодействие веществ с молекулами воды, при котором молекулы воды не разрушаются. Различают слабую и сильную гидратацию. Слабая гидратация свойственна малозарядным ионам с большим радиусом. В случае бромид-ионов (r(Br -) = 0,114 нм) ориентация диполей воды не приводит к образованию химической связи, поэтому число молекул воды в гидратной оболочке постоянно меняется.
Бромид-ионы усиливают процессы торможения в центральной нервной системе (ЦНС), что нашло широкое применение соединений брома в медицинской практике.
Долгое время механизм действия бромидов на ЦНС оставался неизвестным. И в настоящее время роль соединений брома в жизнедеятельности организма еще недостаточно выяснена.
В успокаивающем действии соединений брома находили сходство с действием снотворного, считая, что бромид-ионы понижают возбудимость двигательной сферы головного мозга и уменьшают возбудимость ЦНС.
Лишь в 1910 г. русскому физиологу И.П. Павлову и его ученикам удалось найти правильное объяснение действия брома на ЦНС.
Бром не уменьшает возбудимость, а усиливает процесс торможения. Препараты брома оказались полезными при нарушении нормального соотношения между процессами возбуждения и торможения в коре головного мозга. В этом и заключается целительное действие бромидов на нервную систему. Однако механизм действия бромид-ионов окончательно не выяснен.
В успокаивающем эффекте, помимо усиления процесса торможения ЦНС, может иметь значение влияние этих ионов на гипофиз, надпочечники и половые железы.
Имеются данные, что соединения брома угнетают функцию щитовидной железы и усиливают активность коры надпочечников.
В организм человека бром попадает, главным образом, с пищей растительного происхождения. В растениях бром связан в сложные и большей частью нерастворимые органические соединения. Он всегда есть в растениях, но различные части растений снабжены бромом неодинаково. Больше брома в зеленой части растений, чем в корнях. Содержание брома в минеральной части почв и сухой биомассе растений незначительно и составляет от 10 -10 до 10 -7 %. Некоторые растения, например, бобовые (горох, фасоль, чечевица и др.) активно накапливают бром. Присутствие брома обнаружено также в пшенице и картофеле. Установлено, что сравнительно много брома в съедобных грибах (боровиках и подберезовиках; в подосиновиках его содержание составляет ~1,4´10 -3 %).
Но большая часть брома нашей планеты сосредоточена в морях и в воде соляных озер (в поваренной соли брома содержится 0,1%), особенно высоко его содержание в морских водорослях - морской капусте. Она содержит не только бром, но и йод, а также микроэлементы, витамины и много других, ценных для организма веществ.
Порошок ламинарии принимают для лечения и предупреждения атеросклероза и зоба и других заболеваний.
В качестве лечебных средств применяют препараты NaBr и KBr, хотя наиболее эффективны и менее раздражающие слизистые оболочки бром-органические препараты, которые в ряде случаев стали вытеснять неорганические бромиды. Состав и действие этих препаратов изучают в специальных курсах.
Препараты брома применяют также и при других заболеваниях, например, при сердечно-сосудистых, язвенной болезни и при эпилепсии.
В медицинской практике нашел применение радиоактивный изотоп брома – 82 Br (Т1/2 = 35,8 час) при лечении злокачественных опухолей.
С его помощью изучают механизм действия некоторых бромсодержащих лечебных препаратов.
Бромиды хорошо всасываются из желудочно-кишечного тракта. Клеточные мембраны очень мало проницаемы для крупных бромид-ионов, поэтому они находятся, главным, образом, во внеклеточной жидкости и лишь частично проникают внутрь клеток.
Бром в течение длительного времени выделяется из крови, в тканях же головного мозга его содержится в 3-4 раза меньше. Бром легко задерживается в организме постепенно накапливаясь (кумулируясь). Это может привести к развитию отравления - "бромизму".
При длительном применении бромидов возможно следующее отрицательное влияние: возникает сонливость, ослабление памяти, тремор рук, языка, расстройство речи и общая слабость. В этом случае необходимо прекратить прием бромидов и ускорить их выведение из организма с помощью введения хлорида натрия в количестве 5-10-25 г. В организме человека, существует определенная динамическая связь между содержанием в нем бромид и хлорид-ионов: Br - « Cl - .
Повышение содержания бромид-ионов в крови нарушает это равновесие и, согласно принципу Ле-Шателье, наступает быстрое выделение почками хлорид-ионов, а при избытке хлорид-ионов, наоборот, выделяются из организма бромид-ионы. Поэтому, большой избыток принятого хлорида натрия увеличивает скорость выделения из организма бромид-ионов, что используется при отравлении солями брома.
Бромиды в дозе 1-2 г вызывают психическое и двигательное успокоение; в дозе 3-4 г - сонливость и сон, вялость; в дозе 10-15 г - коматозное состояние, угнетение ЦНС и отравление всего организма.
Лечебные дозы бромидов зависят от типа нервной системы больного и могут колебаться от нескольких миллиграммов до нескольких граммов. Учитывая эти показатели, дозы бромидов подбираются индивидуально.
Токсичность бромид-ионов невысокая, однако, вследствие их медленного выведения из организма (в течение 30-60 суток), они способны накапливаться, вызывая хроническое отравление. При этом необходимо учитывать другое нежелательное явление - взаимозамещаемость галогенид ионов.
Сравнивая некоторые физико-химические показатели галогенов (значения ОЭО, радиусы атомов и ионов и др.), можно отметить, что бром занимает промежуточное положение между хлором и иодом:
Показатели: Cl - Br - I -
ОЭО 3,2 3,0 2,7
r (нм) ионов 0,181 0,196 0,220
Близкие значения этих и других показателей, позволяют бромид-ионам при их избытке замещать иодид-ионы в гормонах щитовидной железы. Такое замещение приводит к недостатку йода в организме, что способствует гиперфункции железы (избыточное образование гормонов). В этом случае наблюдается явление синергизма - усиление активности щитовидной железы (гипертиреоз).
Таким образом, биологическое действие брома зависит от его количества в организме человека и его количественного нарастания при длительном применении соединений брома.
Молекулярный бром (Br 2) в отличие от бромид-ионов очень ядовит. В работе с ним необходимо соблюдать осторожность и соблюдать технику безопасности. Концентрация паров брома ~0,001% в воздухе приводит к головокружению, раздражению слизистых оболочек, кашлю и удушью. При легком отравлении необходимо осторожно вдыхать аммиак. При попадании жидкого брома на руки необходимо его смыть, большим количеством воды и раствором питьевой соды, затем пораженное место смазать мазью, содержащей NaHCO 3 .
Галогены в периодической таблице расположены слева от благородных газов. Эти пять токсических неметаллических элементов входят в 7 группу периодической таблицы. К ним относятся фтор, хлор, бром, йод и астат. Хотя астат радиоактивен и имеет только короткоживущие изотопы, он ведет себя, как йод, и его часто причисляют к галогенам. Поскольку галогенные элементы имеют семь валентных электронов, им необходим лишь один дополнительный электрон для образования полного октета. Эта характеристика делает их более активными, чем другие группы неметаллов.
Общая характеристика
Галогены образуют двухатомные молекулы (вида Х 2 , где Х обозначает атом галогена) - устойчивую форму существования галогенов в виде свободных элементов. Связи этих двухатомных молекул являются неполярными, ковалентными и одинарными. позволяют им легко вступать в соединение с большинством элементов, поэтому они никогда не встречаются в несвязанном виде в природе. Фтор - наиболее активный галоген, а астат - наименее.
Все галогены образуют соли I группы с похожими свойствами. В этих соединениях галогены присутствуют в виде галоидных анионов с зарядом -1 (например, Cl - , Br -). Окончание -ид указывает на наличие галогенид-анионов; например Cl - называется «хлорид».
Кроме того, химические свойства галогенов позволяют им действовать в качестве окислителей - окислять металлы. Большинство химических реакций, в которых участвуют галогены - окислительно-восстановительные в водном растворе. Галогены образуют одинарные связи с углеродом или азотом в где степень их окисления (СО) равна -1. Когда атом галогена замещён ковалентно-связанным атомом водорода в органическом соединении, префикс гало- может быть использован в общем смысле, или префиксы фтор-, хлор-, бром- , йод- - для конкретных галогенов. Галогенные элементы могут иметь перекрёстную связь с образованием двухатомных молекул с полярными ковалентными одинарными связями.
Хлор (Cl 2) стал первым галогеном, открытым в 1774 г., затем были открыты йод (I 2), бром (Br 2), фтор (F 2) и астат (At, обнаружен последним, в 1940 г.). Название «галоген» происходит от греческих корней hal- («соль») и -gen («образовывать»). Вместе эти слова означают «солеобразующий», подчёркивая тот факт, что галогены, вступая в реакцию с металлами, образуют соли. Галит - это название каменной соли, природного минерала, состоящего из хлорида натрия (NaCl). И, наконец, галогены используются в быту - фторид содержится в зубной пасте, хлор обеззараживает питьевую воду, а йод содействует выработке гормонов щитовидной железы.
Химические элементы
Фтор - элемент с атомным номером 9, обозначается символом F. Элементарный фтор впервые был обнаружен в 1886 г. путем выделения его из плавиковой кислоты. В свободном состоянии фтор существует в виде двухатомной молекулы (F 2) и является наиболее распространенным галогеном в земной коре. Фтор - наиболее электроотрицательный элемент в периодической таблице. При комнатной температуре является бледно-жёлтым газом. Фтор также имеет относительно небольшой атомный радиус. Его СО - -1, за исключением элементарного двухатомного состояния, в котором его степень окисления равна нулю. Фтор чрезвычайно химически активен и непосредственно взаимодействует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). В растворе H 2 O, плавиковой кислоты (HF) является слабой кислотой. Хотя фтор сильно электроотрицателен, его электроотрицательность не определяет кислотность; HF является слабой кислотой в связи с тем, что ион фтора основной (рН> 7). Кроме того, фтор производит очень мощные окислители. Например, фтор может вступать в реакцию с инертным газом ксеноном и образует сильный окислитель дифторид ксенона (XeF 2). У фтора множество применений.

Хлор - элемент с атомным номером 17 и химическим символом Cl. Обнаружен в 1774 г. путём выделения его из соляной кислоты. В своём элементарном состоянии он образует двухатомную молекулу Cl 2 . Хлор имеет несколько СО: -1, +1, 3, 5 и 7. При комнатной температуре он является светло-зеленым газом. Так как связь, которая образуется между двумя атомами хлора, является слабой, молекула Cl 2 обладает очень высокой способностью вступать в соединения. Хлор реагирует с металлами с образованием солей, которые называются хлориды. Ионы хлора являются наиболее распространенными ионами, они содержатся в морской воде. Хлор также имеет два изотопа: 35 Cl и 37 Cl. Хлорид натрия является наиболее распространенным соединением из всех хлоридов.
Бром - химический элемент с атомным номером 35 и символом Br. Впервые был обнаружен в 1826 г. В элементарной форме бром является двухатомной молекулой Br 2 . При комнатной температуре представляет собой красновато-коричневую жидкость. Его СО - -1, + 1, 3, 4 и 5. Бром более активен, чем йод, но менее активен, чем хлор. Кроме того, бром имеет два изотопа: 79 Вг и 81 Вг. Бром встречается в бромида, растворённых в морской воде. За последние годы производство бромида в мире значительно увеличилось благодаря его доступности и продолжительному времени жизни. Как и другие галогены, бром является окислителем и очень токсичен.

Йод - химический элемент с атомным номером 53 и символом I. Йод имеет степени окисления: -1, +1, +5 и +7. Существует в виде двухатомной молекулы, I 2 . При комнатной температуре является твёрдым веществом фиолетового цвета. Йод имеет один стабильный изотоп - 127 I. Впервые обнаружен в 1811 г. с помощью морских водорослей и серной кислоты. В настоящее время ионы йода, могут быть выделены в морской воде. Несмотря на то что йод не очень хорошо растворим в воде, его растворимость может возрасти при использовании отдельных йодидов. Йод играет важную роль в организме, участвуя в выработке гормонов щитовидной железы.

Астат - радиоактивный элемент с атомным номером 85 и символом At. Его возможные степени окисления: -1, +1, 3, 5 и 7. Единственный галоген, не являющийся двухатомной молекулой. В нормальных условиях является металлическим твёрдым веществом чёрного цвета. Астат является очень редким элементом, поэтому о нём известно немного. Кроме того, астат имеет очень короткий период полураспада, не дольше нескольких часов. Получен в 1940 г. в результате синтеза. Полагают, что астат похож на йод. Отличается
В таблице ниже показано строение атомов галогенов, структура внешнего слоя электронов.
Подобное строение внешнего слоя электронов обусловливает то, что физические и химические свойства галогенов похожи. Вместе с тем при сопоставлении этих элементов наблюдаются и различия.
Периодические свойства в группе галогенов
Физические свойства простых веществ галогенов изменяются с повышением порядкового номера элемента. Для лучшего усвоения и большей наглядности мы предлагаем вам несколько таблиц.
Точки плавления и кипения в группе возрастают по мере роста размера молекулы (F Таблица 1. Галогены. Физические свойства: точки плавления и кипения Галоген
Т плавления (˚C)
Т кипения (˚C)
Размер ядра увеличивается (F < Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. Таблица 2. Галогены. Физические свойства: атомные радиусы Ковалентный радиус (пм) Ионный (X -) радиус (пм) Если внешние валентные электроны не находятся вблизи ядра, то для их удаления от него не потребуется много энергии. Таким образом, энергия, необходимая для выталкивания внешнего электрона не столь высока в нижней части группы элементов, так как здесь больше энергетических уровней. Кроме того, высокая энергия ионизации заставляет элемент проявлять неметаллические качества. Йод и дисплей астат проявляют металлические свойства, потому что энергия ионизации снижается (At < I < Br < Cl < F). Таблица 3. Галогены. Физические свойства: энергия ионизации Число валентных электронов в атоме возрастает с увеличением уровней энергии при прогрессивно более низких уровнях. Электроны прогрессивно дальше от ядра; Таким образом, ядро и электроны не как притягиваются друг к другу. Увеличение экранирования наблюдается. Поэтому Электроотрицательность уменьшается с ростом периода (At < I < Br < Cl < F). Таблица 4. Галогены. Физические свойства: электроотрицательность Так как размер атома увеличивается с увеличением периода, сродство к электрону, как правило, уменьшается (В < I < Br < F < Cl). Исключение - фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Таблица 5. Сродство галогенов к электрону Реакционная способность галогенов падает с ростом периода (At Галогенид образуется, когда галоген реагирует с другим, менее электроотрицательным элементом с образованием бинарного соединения. Водород реагирует с галогенами, образуя галогениды вида НХ: Галогениды водорода легко растворяются в воде с образованием галогенводородной (плавиковой, соляной, бромистоводородной, иодистоводородной) кислоты. Свойства этих кислот приведены ниже. Кислоты образуются следующей реакцией: HX (aq) + H 2 O (l) → Х - (aq) + H 3 O + (aq). Все галоидоводороды образуют сильные кислоты, за исключением HF. Кислотность галогеноводородных кислот увеличивается: HF Плавиковая кислота способна гравировать стекло и некоторые неорганические фториды длительное время. Может показаться нелогичным, что HF является самой слабой галогенводородной кислотой, так как фтор обладает самой высокой электроотрицательностью. Тем не менее связь Н-F очень сильна, в результате чего кислота очень слабая. Сильная связь определяется короткой длиной связи и большой энергией диссоциации. Из всех галогенидов водорода HF имеет самую короткую длину связи и самую большую энергию диссоциации связи. Галогенные оксокислоты представляют собой кислоты с атомами водорода, кислорода и галогена. Их кислотность может быть определена с помощью анализа структуры. Галогенные оксокислоты приведены ниже: В каждой из этих кислот протон связан с атомом кислорода, поэтому сравнение длин связей протонов здесь бесполезно. Доминирующую роль здесь играет электроотрицательность. Активность кислотны возрастает с увеличением числа атомов кислорода, связанный с центральным атомом. Основные физические свойства галогенов кратко можно выразить в следующей таблице. Состояние вещества (при комнатной температуре)
Галоген
Внешний вид
фиолетовый красно-коричневый газообразное бледно-жёлто-коричневый бледно-зелёный Цвет галогенов является результатом поглощения видимого света молекулами, что вызывает возбуждение электронов. Фтор поглощает фиолетовый свет, и, следовательно, выглядит светло-жёлтым. Йод, наоборот, поглощает жёлтый свет и выглядит фиолетовым (жёлтый и фиолетовый - дополняющие цвета). Цвет галогенов становится темнее с ростом периода. В закрытых ёмкостях жидкий бром и твёрдый йод находятся в равновесии со своими парами, которые можно наблюдать в виде цветного газа. Хотя цвет астата неизвестен, предполагается, что он должен быть темнее йода (т. е. черным) в соответствии с наблюдаемой закономерностью. Теперь, если вас попросят: «Охарактеризуйте физические свойства галогенов», вам будет что сказать. Степень окисления часто используется вместо понятия "валентность галогенов". Как правило, степень окисления равна -1. Но если галоген связан с кислородом или другим галогеном, он может принимать другие состояния: СО кислорода -2 имеет приоритет. В случае двух различных атомов галогена, соединенных вместе, более электроотрицательный атом превалирует и принимает СО -1. Например, в хлориде йода (ICl) хлор имеет СО -1, и йод +1. Хлор является более электроотрицательным, чем йод, поэтому его СО равна -1. В бромной кислоте (HBrO 4) кислород обладает СО -8 (-2 х 4 атома = -8). Водород имеет общую степень окисления +1. Сложение этих значений даёт СО -7. Так как конечное СО соединения должно быть нулевым, то СО брома равна +7. Третьим исключением из правила является степень окисления галогена в элементарной форме (X 2), где его СО равна нулю. Галоген
СО в соединениях
1, +1, +3, +5, +7 1, +1, +3, +4, +5 1, +1, +3, +5, +7 Электроотрицательность увеличивается с ростом периода. Поэтому фтор имеет самую высокую электроотрицательность из всех элементов, что подтверждается его положением в периодической таблице. Его электронная конфигурация 1s 2 2s 2 2p 5 . Если фтор получает еще один электрон, крайние р-орбитали полностью заполнены и составляют полный октет. Поскольку фтор имеет высокую электроотрицательность, он может легко отобрать электрон у соседнего атома. Фтор в этом случае изоэлектронен инертному газу (с восемью валентными электронами), все его внешние орбитали заполнены. В таком состоянии фтор гораздо более стабилен. В природе галогены находятся в состоянии анионов, поэтому свободные галогены получают методом окисления путём электролиза или с помощью окислителей. Например, хлор вырабатывается гидролизом раствора поваренной соли. Применение галогенов и их соединений многообразно. Поговорим о том, что такое галогены. Они находятся в седьмой группе (главной подгруппе) таблицы Менделеева. В переводе с греческого языка "галоген" означает "рождающий соль". В статье пойдет речь о том, что собой представляет химический галоген, какие вещества объединены под этим термином, каковы их свойства и особенности получения. Рассуждая о том, что такое галогены, отметим специфику строения их атомов. У всех элементов на внешнем энергетическом уровне располагается по семь электронов, причем один из них является неспаренным (свободным). Поэтому ярко выражены окислительные свойства галогенов, то есть присоединение одного электрона во время взаимодействия с различными веществами, что приводит к полному завершению внешнего энергетического уровня, образованию устойчивых конфигураций галогенидов. С металлами они образуют прочную связь ионного характера. К ним относятся следующие элементы: фтор, хлор, бром, йод. Формальное отношение к ним имеют астат и теннесин. Для того чтобы понять, что такое галогены, необходимо отметить, что у хлора, брома, йода есть свободная орбиталь. Именно она объясняет различные степени окисления у данных элементов. Например, хлор имеет следующие величины: -1, +1,+3, +5, +7. При сообщении атому хлора дополнительной энергии, происходит постепенный переход электронов, который и объясняет изменения в степенях окисления. Среди самых устойчивых конфигураций хлора выделяют его соединения, в которых проявляется степень окисления -1, а также +7. Особенности строения объясняют их распространенность в природе. Соединения галогенов в природе представлены в виде галогенидов, хорошо растворимых в воде. С увеличением атомного радиуса галогена происходит снижение их количественного содержания в земной коре. Например, некоторые соединения брома, хлора, фтора используют в промышленных объемах. В качестве основного соединения фтора, представленного в природе, можно отметить фторид кальция (флюорит). Для того чтобы понять, что такое галогены, необходимо выяснить способы их получения. Основным вариантом выделения чистых галогенов из солей является электролиз расплавов солей. Например, при воздействии на хлорид натрия постоянного электрического тока в качестве продуктов реакции можно рассматривать не только газообразный хлор, но и металлический натрий. На катоде происходит восстановление металла, а галоген образуется на аноде. Для получения брома используют морскую воду, проводя электролиз этого раствора. Остановимся на физических свойствах представителей седьмой группы главной подгруппы. Фтор при обычных условиях является газообразным веществом, имеющим светло-желтый цвет, резкий и раздражающий запах. Газообразен и желто-зеленый хлор, имеющий резкое удушливое амбре. Бром является коричневой тяжелой жидкостью. Из всех галогенов только йод - кристаллическое вещество фиолетового цвета. Самым сильным окислителем является фтор. В группе способность присоединять электрон во время химической реакции постепенно снижается от фтора к астату. Причина ослабления этого свойства заключается в увеличении атомного радиуса. Фтор, являясь самым сильным окислителем, способен вступать без дополнительного нагревания во взаимодействие практически со всеми неметаллами. Процесс сопровождается выделением большого количества теплоты. С металлами процесс характеризуется самовоспламенением фтора. Поскольку данный галоген отличается высокой химической активностью, он способен взаимодействовать при облучении с благородными газами. Фтор вступает во взаимодействие и со сложными веществами. У брома активность существенно ниже. В основном он используется в органической химии для проведения качественных реакций на непредельные соединения. Йод вступает во взаимодействие с металлами только при нагревании, причем процесс характеризуется поглощением энергии (экзотермическая реакция). Каково значение галогенов? Для того чтобы ответить на этот вопрос, рассмотрим основные области их применения. Например, природный минерал криолит, являющийся соединением алюминия, фтора, натрия, используется в качестве добавки в зубную пасту, способствует предотвращению кариеса. Хлор в больших количествах применяют в производстве соляной кислоты. Кроме того, этот галоген востребован в изготовлении пластических масс, растворителей, красителей, каучуков, синтетических волокон. Большое количество хлорсодержащих соединений применяется для эффективной борьбы с различными вредителями сельскохозяйственных культур. Хлор, а также его соединения необходимы и для процесса отбеливания хлопчатобумажных и льняных тканей, бумаги, обеззараживания питьевой воды. Бром и йод используют в химической и фармацевтической промышленности. В последнее время вместо хлора для очистки питьевой воды стали использовать озон. Высокая реакционная способность галогенов объясняет тот факт, что все эти соединения являются ядами, имеющими удушающее действие, способными поражать органические ткани. Несмотря на такие характеристики, данные элементы необходимы для процессов жизнедеятельности человеческого организма. Например, фтор участвует в обменных процессах в нервных клетках, мышцах, железах. В быту все чаще встречается тефлоновая посуда, одним из компонентов которой является именно фтор. Хлор способствует росту волос, стимулирует обменные процессы, дает организму силы и бодрость. Максимальное количество его в виде хлорида натрия входит в состав плазмы крови. Среди соединений данного элемента особый интерес с биологической точки зрения представляет соляная кислота. Именно она является основой желудочного сока, участвует в процессах расщепления пищи. Для того чтобы организм функционировал нормально, в сутки человек должен употреблять не меньше двадцати граммов поваренной соли. Все галогены необходимы человеку для жизнедеятельности, а также используются им в разных сферах деятельности. Галогены в периодической таблице расположены слева от благородных газов. Эти пять токсических неметаллических элементов входят в 7 группу периодической таблицы. К ним относятся фтор, хлор, бром, йод и астат. Хотя астат радиоактивен и имеет только короткоживущие изотопы, он ведет себя, как йод, и его часто причисляют к галогенам. Поскольку галогенные элементы имеют семь валентных электронов, им необходим лишь один дополнительный электрон для образования полного октета. Эта характеристика делает их более активными, чем другие группы неметаллов. Галогены образуют двухатомные молекулы (вида Х2, где Х обозначает атом галогена) – устойчивую форму существования галогенов в виде свободных элементов. Связи этих двухатомных молекул являются неполярными, ковалентными и одинарными. Химические свойства галогенов позволяют им легко вступать в соединение с большинством элементов, поэтому они никогда не встречаются в несвязанном виде в природе. Фтор – наиболее активный галоген, а астат – наименее. Все галогены образуют соли I группы с похожими свойствами. В этих соединениях галогены присутствуют в виде галоидных анионов с зарядом -1 (например, Cl-, Br-). Окончание -ид указывает на наличие галогенид-анионов; например Cl- называется «хлорид». Кроме того, химические свойства галогенов позволяют им действовать в качестве окислителей – окислять металлы. Большинство химических реакций, в которых участвуют галогены – окислительно-восстановительные в водном растворе. Галогены образуют одинарные связи с углеродом или азотом в органических соединениях, где степень их окисления (СО) равна -1. Когда атом галогена замещён ковалентно-связанным атомом водорода в органическом соединении, префикс гало- может быть использован в общем смысле, или префиксы фтор-, хлор-, бром- , йод- – для конкретных галогенов. Галогенные элементы могут иметь перекрёстную связь с образованием двухатомных молекул с полярными ковалентными одинарными связями. Хлор (Cl2) стал первым галогеном, открытым в 1774 г., затем были открыты йод (I2), бром (Br2), фтор (F2) и астат (At, обнаружен последним, в 1940 г.). Название «галоген» происходит от греческих корней hal- («соль») и -gen («образовывать»). Вместе эти слова означают «солеобразующий», подчёркивая тот факт, что галогены, вступая в реакцию с металлами, образуют соли. Галит – это название каменной соли, природного минерала, состоящего из хлорида натрия (NaCl). И, наконец, галогены используются в быту – фторид содержится в зубной пасте, хлор обеззараживает питьевую воду, а йод содействует выработке гормонов щитовидной железы. Фтор – элемент с атомным номером 9, обозначается символом F. Элементарный фтор впервые был обнаружен в 1886 г. путем выделения его из плавиковой кислоты. В свободном состоянии фтор существует в виде двухатомной молекулы (F2) и является наиболее распространенным галогеном в земной коре. Фтор – наиболее электроотрицательный элемент в периодической таблице. При комнатной температуре является бледно-жёлтым газом. Фтор также имеет относительно небольшой атомный радиус. Его СО – -1, за исключением элементарного двухатомного состояния, в котором его степень окисления равна нулю. Фтор чрезвычайно химически активен и непосредственно взаимодействует со всеми элементами, кроме гелия (He), неона (Ne) и аргона (Ar). В растворе H2O, плавиковой кислоты (HF) является слабой кислотой. Хотя фтор сильно электроотрицателен, его электроотрицательность не определяет кислотность; HF является слабой кислотой в связи с тем, что ион фтора основной (рН> 7). Кроме того, фтор производит очень мощные окислители. Например, фтор может вступать в реакцию с инертным газом ксеноном и образует сильный окислитель дифторид ксенона (XeF2). У фтора множество применений. Хлор – элемент с атомным номером 17 и химическим символом Cl. Обнаружен в 1774 г. путём выделения его из соляной кислоты. В своём элементарном состоянии он образует двухатомную молекулу Cl2. Хлор имеет несколько СО: -1, +1, 3, 5 и 7. При комнатной температуре он является светло-зеленым газом. Так как связь, которая образуется между двумя атомами хлора, является слабой, молекула Cl2 обладает очень высокой способностью вступать в соединения. Хлор реагирует с металлами с образованием солей, которые называются хлориды. Ионы хлора являются наиболее распространенными ионами, они содержатся в морской воде. Хлор также имеет два изотопа: 35Cl и 37Cl. Хлорид натрия является наиболее распространенным соединением из всех хлоридов. Бром – химический элемент с атомным номером 35 и символом Br. Впервые был обнаружен в 1826 г. В элементарной форме бром является двухатомной молекулой Br2. При комнатной температуре представляет собой красновато-коричневую жидкость. Его СО – -1, + 1, 3, 4 и 5. Бром более активен, чем йод, но менее активен, чем хлор. Кроме того, бром имеет два изотопа: 79Вг и 81Вг. Бром встречается в виде солей бромида, растворённых в морской воде. За последние годы производство бромида в мире значительно увеличилось благодаря его доступности и продолжительному времени жизни. Как и другие галогены, бром является окислителем и очень токсичен. Йод – химический элемент с атомным номером 53 и символом I. Йод имеет степени окисления: -1, +1, +5 и +7. Существует в виде двухатомной молекулы, I2. При комнатной температуре является твёрдым веществом фиолетового цвета. Йод имеет один стабильный изотоп — 127I. Впервые обнаружен в 1811 г. с помощью морских водорослей и серной кислоты. В настоящее время ионы йода, могут быть выделены в морской воде. Несмотря на то что йод не очень хорошо растворим в воде, его растворимость может возрасти при использовании отдельных йодидов. Йод играет важную роль в организме, участвуя в выработке гормонов щитовидной железы. Астат – радиоактивный элемент с атомным номером 85 и символом At. Его возможные степени окисления: -1, +1, 3, 5 и 7. Единственный галоген, не являющийся двухатомной молекулой. В нормальных условиях является металлическим твёрдым веществом чёрного цвета. Астат является очень редким элементом, поэтому о нём известно немного. Кроме того, астат имеет очень короткий период полураспада, не дольше нескольких часов. Получен в 1940 г. в результате синтеза. Полагают, что астат похож на йод. Отличается металлическими свойствами. В таблице ниже показано строение атомов галогенов, структура внешнего слоя электронов. Подобное строение внешнего слоя электронов обусловливает то, что физические и химические свойства галогенов похожи. Вместе с тем при сопоставлении этих элементов наблюдаются и различия. Физические свойства простых веществ галогенов изменяются с повышением порядкового номера элемента. Для лучшего усвоения и большей наглядности мы предлагаем вам несколько таблиц. Точки плавления и кипения в группе возрастают по мере роста размера молекулы (F Таблица 1. Галогены. Физические свойства: точки плавления и кипения Размер ядра увеличивается (F < Cl < Br < I < At), так как увеличивается число протонов и нейтронов. Кроме того, с каждым периодом добавляется всё больше уровней энергии. Это приводит к большей орбитали, и, следовательно, к увеличению радиуса атома. Таблица 2. Галогены. Физические свойства: атомные радиусы Если внешние валентные электроны не находятся вблизи ядра, то для их удаления от него не потребуется много энергии. Таким образом, энергия, необходимая для выталкивания внешнего электрона не столь высока в нижней части группы элементов, так как здесь больше энергетических уровней. Кроме того, высокая энергия ионизации заставляет элемент проявлять неметаллические качества. Йод и дисплей астат проявляют металлические свойства, потому что энергия ионизации снижается (At < I < Br < Cl < F). Таблица 3. Галогены. Физические свойства: энергия ионизации Число валентных электронов в атоме возрастает с увеличением уровней энергии при прогрессивно более низких уровнях. Электроны прогрессивно дальше от ядра; Таким образом, ядро и электроны не как притягиваются друг к другу. Увеличение экранирования наблюдается. Поэтому Электроотрицательность уменьшается с ростом периода (At < I < Br < Cl < F). Таблица 4. Галогены. Физические свойства: электроотрицательность Так как размер атома увеличивается с увеличением периода, сродство к электрону, как правило, уменьшается (В < I < Br < F < Cl). Исключение – фтор, сродство которого меньше, чем у хлора. Это можно объяснить меньшим размером фтора по сравнению с хлором. Таблица 5. Сродство галогенов к электрону Реакционная способность галогенов падает с ростом периода (At Галогенид образуется, когда галоген реагирует с другим, менее электроотрицательным элементом с образованием бинарного соединения. Водород реагирует с галогенами, образуя галогениды вида НХ: Галогениды водорода легко растворяются в воде с образованием галогенводородной (плавиковой, соляной, бромистоводородной, иодистоводородной) кислоты. Свойства этих кислот приведены ниже. Кислоты образуются следующей реакцией: HX (aq) + H2O (l) → Х- (aq) + H3O+ (aq). Все галоидоводороды образуют сильные кислоты, за исключением HF. Кислотность галогеноводородных кислот увеличивается: HF Плавиковая кислота способна гравировать стекло и некоторые неорганические фториды длительное время. Может показаться нелогичным, что HF является самой слабой галогенводородной кислотой, так как фтор обладает самой высокой электроотрицательностью. Тем не менее связь Н-F очень сильна, в результате чего кислота очень слабая. Сильная связь определяется короткой длиной связи и большой энергией диссоциации. Из всех галогенидов водорода HF имеет самую короткую длину связи и самую большую энергию диссоциации связи. Галогенные оксокислоты представляют собой кислоты с атомами водорода, кислорода и галогена. Их кислотность может быть определена с помощью анализа структуры. Галогенные оксокислоты приведены ниже: В каждой из этих кислот протон связан с атомом кислорода, поэтому сравнение длин связей протонов здесь бесполезно. Доминирующую роль здесь играет электроотрицательность. Активность кислотны возрастает с увеличением числа атомов кислорода, связанный с центральным атомом. Основные физические свойства галогенов кратко можно выразить в следующей таблице. Цвет галогенов является результатом поглощения видимого света молекулами, что вызывает возбуждение электронов. Фтор поглощает фиолетовый свет, и, следовательно, выглядит светло-жёлтым. Йод, наоборот, поглощает жёлтый свет и выглядит фиолетовым (жёлтый и фиолетовый – дополняющие цвета). Цвет галогенов становится темнее с ростом периода. В закрытых ёмкостях жидкий бром и твёрдый йод находятся в равновесии со своими парами, которые можно наблюдать в виде цветного газа. Хотя цвет астата неизвестен, предполагается, что он должен быть темнее йода (т. е. черным) в соответствии с наблюдаемой закономерностью. Теперь, если вас попросят: «Охарактеризуйте физические свойства галогенов», вам будет что сказать. Степень окисления часто используется вместо понятия «валентность галогенов». Как правило, степень окисления равна -1. Но если галоген связан с кислородом или другим галогеном, он может принимать другие состояния: СО кислорода -2 имеет приоритет. В случае двух различных атомов галогена, соединенных вместе, более электроотрицательный атом превалирует и принимает СО -1. Например, в хлориде йода (ICl) хлор имеет СО -1, и йод +1. Хлор является более электроотрицательным, чем йод, поэтому его СО равна -1. В бромной кислоте (HBrO4) кислород обладает СО -8 (-2 х 4 атома = -8). Водород имеет общую степень окисления +1. Сложение этих значений даёт СО -7. Так как конечное СО соединения должно быть нулевым, то СО брома равна +7. Третьим исключением из правила является степень окисления галогена в элементарной форме (X2), где его СО равна нулю. Электроотрицательность увеличивается с ростом периода. Поэтому фтор имеет самую высокую электроотрицательность из всех элементов, что подтверждается его положением в периодической таблице. Его электронная конфигурация 1s2 2s2 2p5. Если фтор получает еще один электрон, крайние р-орбитали полностью заполнены и составляют полный октет. Поскольку фтор имеет высокую электроотрицательность, он может легко отобрать электрон у соседнего атома. Фтор в этом случае изоэлектронен инертному газу (с восемью валентными электронами), все его внешние орбитали заполнены. В таком состоянии фтор гораздо более стабилен. В природе галогены находятся в состоянии анионов, поэтому свободные галогены получают методом окисления путём электролиза или с помощью окислителей. Например, хлор вырабатывается гидролизом раствора поваренной соли. Применение галогенов и их соединений многообразно. >> Химия: Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов
. Фтор и хлор получают электролизом расплавов или растворов их солей. Например, процесс элек-| тролиза расплава хлорида натрия можно отразить уравнением: Но если водород можно получить другими, более удобными и дешевыми способами, например из природного газа, то гидроксид натрия получают почти исключительно электролизом раствора поваренной соли , как и хлор. Бром и иод получают в промышленности по реакции вытеснения их соответственно из бромидов и иодидов. Биологическое значение галогенов.
Их применение. Вы не могли не обратить внимание, что на этикетках многих марок зубных паст указывается на содержание в них фтора - конечно, не свободного, а его соединений. Благодаря этому важному компоненту, участвующему в построении зубной эмали и костей, предотвращается такое заболевание, как кариес зубов . Кроме того, фтор является необходимым элементом в процессах обмена веществ в железах, мышцах и нервных клетках. Важное значение имеет фтор и в промышленном производстве, где основные потребители его - ядерная промышленность и электротехника. Его соединение Nа3АlF6 (как оно называется?) используется для производства алюминия. А в быту все более широкое применение находит тефлоновая посуда, название которой дано по фторсодержащей пластмассе - тефлону. Хлор
- один из химических элементов, без которых немыслимо существование живых организмов. Основная форма его. поступления в организм - это хлорид натрия. Он стимулирует обмен веществ, рост волос, придает бодрость и силу. Больше всего NаСl содержится в плазме крови. Особую роль в пищеварении играет соляная кислота НС1, которая входит в состав желудочного сока. Без 0,2%-ной НСl практически прекращается процесс переваривания пищи. И хотя почти все пищевые продукты содержат некоторое количество поваренной соли, человек вынужден добавлять к пище ежедневно около 20 г соли. По масштабам промышленного применения хлор намного превосходит все галогены . Хлор и его соединения необходимы для отбеливания льняных и хлопчатобумажных тканей, бумаги и т. д. Особенно много его расходуется в органическом синтезе для производства пластмасс, каучуков, красителей и растворителей (рис. 20). Многие хлорсодержащие соединения используют для борьбы с вредителями сельского хозяйства. В больших количествах хлор потребляется для обеззараживания питьевой воды, правда, далеко не без отрицательных последствий (какое вещество безопаснее применять для этой цели?). В цветной металлургии методом хлорирования руд извлекают из них некоторые металлы (титан, ниобий, тантал). Хлор нашел применение и в военных целях в качестве боевого отравляющего средства. Позднее он был заменен другими, более эффективными хлорсодержащими отравляющими веществами, например фосгеном СОСl2. Хлор содержится в очень опасном для жизни и здоровья веществе - диоксине. Соединения хлора - одна из причин разрушения озонового слоя Земли. Еще один галоген - бром также весьма важен для организма человека. Соединения этого элемента регулируют процессы возбуждения и торможения центральной нервной системы, поэтому для лечения нервных болезней (бессонницы, истерии, неврастении и т. д.) врачи прописывают «бром» - бромсодер-жащие препараты. Бром активно накапливают некоторые растения, и в том числе морские водоросли . Именно в море сосредоточена большая часть брома на нашей планете, и море служит главным поставщиком брома. Подсчитано, что ежегодно вместе с морской водой в воздух переходит около 4 млн т брома. Понятно, что содержание его в воздухе приморских районов всегда больше, чем в районах, далеких от моря. Это одна из причин, почему так полезно дышать морским воздухом. Не менее важную роль бром, а точнее, бромид серебра АgВr играет в фотографии. Те, кто занимается фотографией, вероятно, сразу же вспомнят названия сортов фотобумаги - «Уни-бром», «Бромпортрет» и др. Фотобумага содержит нанесенный на нее с помощью желатина слой бромида серебра, который легко разлагается под действием света: 2АgВr = 2Ag + Br2 И наконец, последний из рассматриваемых нами галогенов - иод - это тот элемент, без которого человек не может жить: недостаток его в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Под регулирующим действием гормона щитовидной железы находятся мускульное возбуждение, биение сердца, аппетит, пищеварение , работа мозга и темперамент человека. Иод попадает в организм вместе с пищей: хлебом, яйцами, молоком, водой, морской капустой и с воздухом (особенно морским) при дыхании. Спиртовой раствор иода (5-10% -ный), называемый йодной настойкой, применяется для обработки ран. Иод входит в состав многих лекарств. Главными потребителями иода являются фармацевтичеcкая и химическая промышленность , а также производство светочувствительных фотоматериалов. 1. Получение галогенов электролизом расплавов и растворов солей. 2. Биологическое значение галогенов. 3. Применение хлора и соединений фтора, хлора и иода. Какой объем хлора (н. у.) и какую массу натрия можно получить при электролизе 585 г хлорида натрия, содержащего 2% примесей? Рассчитайте, сколько граммов 40%-ного раствора щелочи можно получить из натрия, массу которого вы определили в предыдущей задаче. Французский химик Шееле получил хлор по реакции оксида марганца(IV) с соляной кислотой. В результате этой реакции образуются также хлорид марганца(II) и вода. Составьте уравнение этой реакции, рассмотрите окислительно-восстановительные процессы и рассчитайте массу оксида марганца(IV) и количество хлороводорода, необходимых для получения 100 л хлора (н. у.), если выход его составляет 95% от теоретически возможного. Подготовьте сообщение о положительном и отрицательном значении галогенов в жизни человека.

Водород + галогены
Галогенные оксокислоты
Внешний вид и состояние вещества
Объяснение внешнего вида

Степень окисления галогенов в соединениях
Почему СО фтора всегда -1?
Получение и применение галогенов

Особенности

Представители галогенов

Нахождение в природе

Особенности получения
Физические свойства

Особенности химических свойств
Особенности использования
Биологическое действие
Общая характеристика
Химические элементы
Периодические свойства в группе галогенов
Неорганическая химия. Водород + галогены
Галогенные оксокислоты
Внешний вид и состояние вещества
Объяснение внешнего вида
Степень окисления галогенов в соединениях
Почему СО фтора всегда -1?
Получение и применение галогенов